保健食品备案最新规定,企业合规必备!
以下是截至2025年保健食品备案管理的最新规定要点,综合国家市场监管总局及地方监管部门最新文件整理:
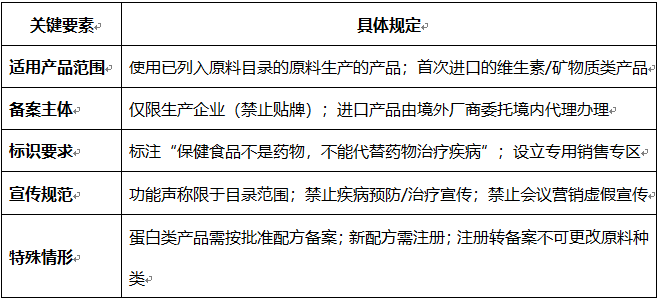
一、备案适用范围
1. 原料目录内产品
使用已列入《保健食品原料目录》的原料(如维生素、矿物质、大豆分离蛋白、乳清蛋白等)生产的保健食品,需进行备案。
o 示例:2023年10月新增大豆分离蛋白、乳清蛋白目录,允许备案产品声称“有助于增强免疫力”。
2. 特定进口产品
首次进口的维生素、矿物质类营养物质保健食品需备案(非此类营养物质的首批进口产品需注册)。

二、备案主体与程序
1. 备案主体
o 仅限生产企业(禁止贴牌生产),进口产品由境外厂商委托境内代理机构办理。
o 国产保健食品向省级市场监管部门备案;进口维生素/矿物质类向国家总局备案。
2. 备案流程
o 材料齐全且符合要求:当场备案并公布信息。
o 材料不符:一次性告知补正。
o 需提交材料包括产品配方、工艺、安全性评价、标签说明书等。
三、产品标识与宣传规范
1. 标签与说明书
o 必须标注:“保健食品不是药物,不能代替药物治疗疾病”。
o 功能声称仅限目录范围,不得涉及疾病预防/治疗功效。
2. 销售专区要求
o 设立专用柜台/货架,标注“保健食品销售专区(专柜)”,禁止与普通食品或药品混放。
3. 禁止性规定
o 名称不得含“特效”“治疗”等暗示疗效的词语;
o 禁止通过会议、健康咨询等方式虚假宣传。
四、监管与经营要求
1. 进货与销售管理
o 经营者需查验供货方资质及产品合格证明,建立进货台账。
o 实行明码标价,禁止价格欺诈。
2. 违规处罚
o 虚假宣传、未专区销售、材料造假等行为将面临从严查处。
五、最新动态与特殊情形
1. 目录扩展与剂型调整
o 2024年糖果、饮料等剂型纳入备案范围等。
o 原料目录动态更新,遵循“成熟一个、发布一个”原则。
o 2025年计划开展小复方保健食品备案试行。
2. 特殊案例处理
o 蛋白类产品配伍营养素:若使用未批准的配方或新增原料,需转为注册管理。
o 注册转备案:配方原料种类不可更改,营养素用量不得超目录上限。
保健食品备案核心要求一览表
下表总结了备案管理的关键要素,帮助快速掌握合规要点:
总结
保健食品备案制通过简化流程降低合规成本,但严守原料目录与功能声称的科学边界。企业需重点关注原料目录扩展动态(如新纳入的蛋白类原料)及剂型放宽政策,同时杜绝任何暗示疗效的宣传。监管部门通过“备案即公开”“强化事后监管”实现社会共治。
建议企业通过省级市场监管部门官网或国家总局备案系统查询实时目录及技术要求,确保合规更新。
小蓝中康(北京)科技有限公司-保健食品研发领域领先技术服务商,为您提供研发·注册·备案·转让的管家式服务。
注:以上内容均由AI搜集总结并生成,仅供参考。若您期望获取专业服务,请致电400-070-1617进行咨询。












