益生菌保健食品“双轨制”:注册与备案的路径与机遇
益生菌保健食品的注册制和备案制是我国保健食品市场准入的两种管理模式,核心区别在于适用产品类型、审批流程、技术要求及监管强度。以下是具体分析:
一、适用产品范围
1. 注册制:
o 适用情形:
使用《保健食品原料目录》以外原料的益生菌产品(如新菌株或创新配方);
首次进口的非维生素矿物质类益生菌保健食品(如功能性产品)。

o 现状:
目前益生菌尚未纳入保健食品原料目录,因此绝大多数益生菌类保健食品必须通过注册制上市。
2. 备案制:
o 适用情形:
使用《保健食品原料目录》内原料的国产产品(如维生素、矿物质等标准化原料);
首次进口的维生素矿物质类营养素补充剂。
o 益生菌的特殊性:
由于益生菌未被纳入现行原料目录,目前无法通过备案制上市。但监管部门正在推进益生菌原料目录研究,未来可能开放备案。
二、审批流程与周期
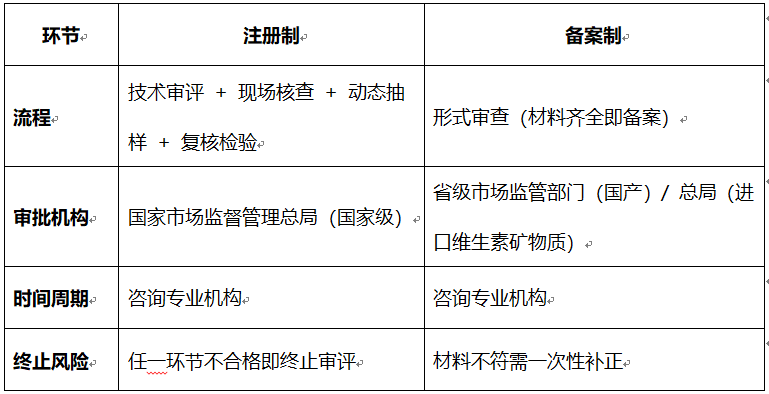
说明:
• 注册制需提交九大类材料,包括菌株鉴定报告、毒理试验、功能验证(如调节肠道菌群)等;备案制仅需生产工艺说明、检验报告等基础材料。
• 益生菌注册还需满足菌株水平管理(非菌种)、保质期内活菌数≥10⁷ CFU/g等新规。
三、技术要求差异
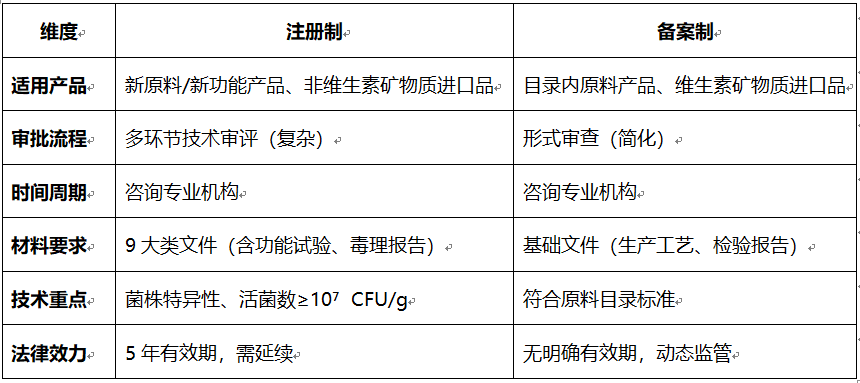
1. 菌株特异性要求:
o 注册制需提供菌株级安全与功效数据(同一菌种不同菌株功效可能不同),而备案制原料已预审,无需重复验证。
2. 活菌数与有效期:
o 注册制要求保质期内活菌数 ≥10⁷ CFU/g(高于旧规10⁶ CFU/g),确保功效持续;备案制按原料目录标准执行。
3. 功能声称:
o 注册制可申请特定保健功能(如“增强免疫力”);备案制功能声称限于目录规定,不可新增。
四、市场影响与成本
• 注册制:
o 成本高:需投入数百万元研发及试验费用,耗时长达数年。
o 独占性强:注册证书有效期5年,期间享有市场排他性。
o 现状:全国仅约140款获批益生菌保健食品,同质化严重(功能集中于肠道调节、免疫)。
• 备案制(未来展望):
o 若益生菌纳入原料目录,上市周期缩短至数月,成本大幅降低。
o 可能推动细分品类创新(如儿童/女性专用益生菌)。
注册制 vs 备案制对比总结
五、企业策略建议
1. 产品定位:
o 创新菌株/功能 → 选择注册制(如复合功能型益生菌);
o 成熟配方 → 未来优先备案制(需等待益生菌纳入原料目录)。
2. 研发方向:
o 聚焦菌株差异化;
o 确保活菌稳定性技术(如包埋工艺)以满足注册制高要求。
3. 政策跟进:
o 关注《保健食品原料 益生菌剂》国标制定(填补标准空白)及备案目录动态。
未来趋势上,注册制仍是当前益生菌功能声称产品的唯一合规路径,但备案制开放将加速市场扩容。企业需平衡创新投入与政策红利,提前布局菌株资源库以应对双轨制演进。
(更多细节可参考国家市场监督管理总局官网或咨询专业机构如:小蓝中康)
小蓝中康(北京)科技有限公司-保健食品研发领域领先技术服务商,为您提供研发·注册·备案·转让的管家式服务。
注:以上内容均由AI搜集总结并生成,仅供参考。若您期望获取专业服务,请致电400-070-1617进行咨询。
点击进入~获取专属方案,服务热线:400-070-1617、13261985261(微信同号)












