DeepSeek:保健食品注册申请全流程解析与核心要求
关于保健食品注册的申请流程与核心要求,综合《保健食品注册与备案管理办法》及相关指南,整理关键信息如下:
一、适用范围(需注册的情形)
1. 目录外原料产品:使用《保健食品原料目录》以外原料的国产或进口产品;
2. 首次进口产品:非维生素/矿物质类营养补充剂的首次进口保健食品(同一国家、企业、配方首次在中国上市)。

二、注册流程与时间
1. 基础流程
•材料准备:包括研发报告、配方工艺、安全性评价等10类核心材料(详见下文材料清单);
•系统填报:通过国家食品药品监管总局网站或保健食品审评中心系统在线填写申请表并上传材料;
•形式审查:受理机构审核材料完整性(5个工作日内决定是否受理);
•技术审评:审评机构组织专家评估安全性、功能及质量可控性(约需2-3年);
•现场核查:查验机构对生产条件、工艺流程等进行实地审查;
•行政审批:通过后颁发注册证书(有效期5年)。
2. 特殊情形
•补充材料:收到《审评意见通知书》后,需在3个月内一次性提交补充材料;
•延续注册:需在证书到期前6个月提出申请。
三、申请材料清单(核心要求)
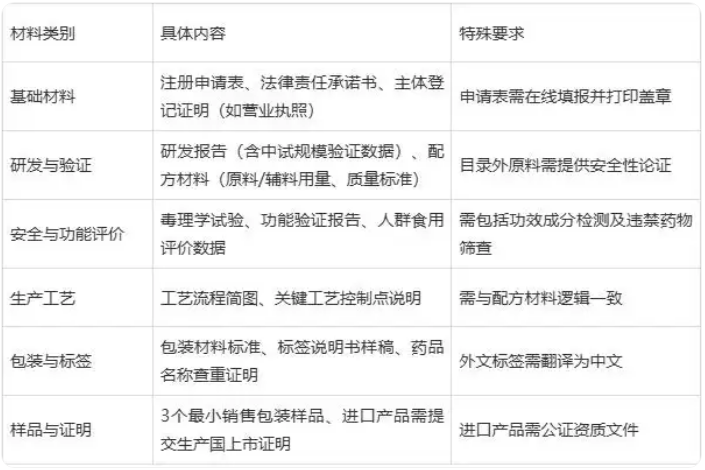
四、注册与备案的区别
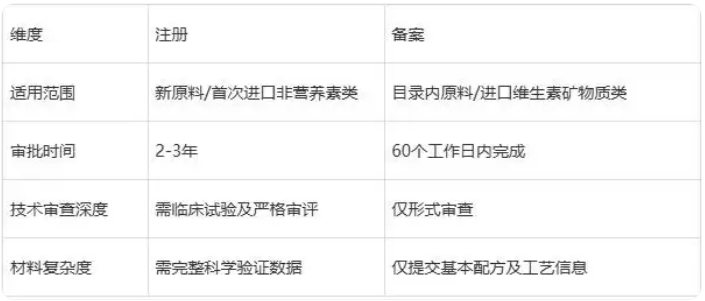
五、注意事项
1. 材料一致性:所有文件中的产品名称、申请人信息需完全一致,外文材料需翻译并公证;
2. 电子化提交:材料需扫描为PDF上传系统,原件与复印件均需提交;
3. 变更管理:注册期间不可同步申请转让技术,但可补充变更注册人信息;
4. 证书补发:需在省级监管部门网站发布遗失声明或交回损坏原件。
建议申请前通过国家市场监督管理总局官网(www.samr.gov.cn )或审评中心网站(www.cfe-samr.org.cn)获取最新模板,并咨询省级监管部门确认地方性要求。
注:文章仅供参考,不作为任何依据使用,若您期望获取专业服务,请致电400-070-1617进行咨询。












