2025新规下,保健食品再注册流程详解,要点须知道!
以下是保健食品再注册流程的详细解析,结合最新法规(截至2025年7月)及实务操作要点整理而成:
一、适用对象与时间要求
1. 适用范围
o 所有国产及进口保健食品注册证书(有效期5年)到期前需申请延续注册。
o 特殊情形:历史遗留的“双无”产品(无有效期/无技术要求)需在2028年8月15日前完成换证。
2. 时间节点
o 提前6个月提交申请:逾期可能导致证书注销,仅对2018年前到期产品提供特殊宽限期(如2018年3月31日前补申请)。
o 并行申请限制:若同时涉及技术转让申请,需在前一申请获批后30日内提出再注册申请。或撤销转让申请后提交延续申请。

二、核心流程与材料清单
1. 材料准备阶段
• 基础材料
o 延续注册申请表、原注册证书复印件、主体资格证明(营业执照等)、产品技术要求及检验报告。
• 国产产品附加材料
o 省级监管部门出具的生产销售证明、五年内销售总结、消费者反馈报告、人群食用分析报告。
• 进口产品附加材料
o 生产国(地区)资质证明、出口国上市证明、报关单及销售发票。
• 其他要求
o 所有材料需真实、完整,外文文件需翻译公证。
2. 提交与审核流程
• 提交方式
o 通过国家市场监督管理总局政务平台或省级窗口提交。
• 形式审查
o 核对材料完整性,需补正则一次性告知。
• 技术审评
o 审评机构组织专家审查材料,并可能启动现场核查(检查生产条件、工艺一致性及质量管理体系)。
• 审批决定
o 省级审查时限约20个工作日(不含补正或检验时间),获批后颁发新证书(有效期5年)。
3. 证书发放与格式
• 国产文号:国食健注G+年份+顺序号
• 进口文号:国食健注J+年份+顺序号。
三、特殊情形处理
1. “双无”产品换证
o 适用范围:历史遗留的未设有效期或技术要求的产品。
o 流程:
登录总局系统提交申请 → 省局组织现场评审 → 核验配方、工艺、技术要求“三要件” → 提供生产一致性证明及安全性市场反馈报告。
2. 注册转备案情形
o 若原料已纳入《保健食品原料目录》,但剂型需调整:
先申请延续注册 → 技术审评通过后启动剂型增补 → 目录更新后转为备案。
3. 证书异常处理
o 遗失或损坏:国产产品需发布遗失声明,进口产品需交回原件补办。
o 逾期未申请:需书面说明理由,经省级部门审核后方可受理。
四、2025年新规强化要求
1. 安全性评估升级
o 所有产品需提交《食用安全性分析报告》,包含人群不良反应数据。
2. 追溯系统对接
o 企业需在2025年底前接入国家保健食品追溯平台(执行GB 12904编码),否则影响延续注册。
3. 年度报告制度
o 每年1月提交上年度产销情况,逾期未报将被列入异常目录。
五、高频风险与实务建议
1. 常见驳回原因
• 未提供生产销售证明或技术要求与现行法规不符。
• 工艺参数模糊、检验方法未验证。
• 产品原料或工艺不符合《保健食品原料目录》要求。
2. 实务操作建议
• 提前规划:预留6个月以上操作周期,关注省级细则(如辽宁、山西等22省已发布方案)。
• 材料真实性:确保生产工艺、配方与历史批件一致,现场核查重点验证“三要件”。
• 专业支持:
o “双无”产品建议“一品一策”,平衡试验成本与合规风险。
o 关注总局审评中心动态,及时调整标签说明书(按2024版《警示用语指南》)。
3. 系统填报提醒
• 实行“提交即锁定”机制,材料一经提交不可撤回,务必提前与省级部门确认材料完整性。
六、流程概览表
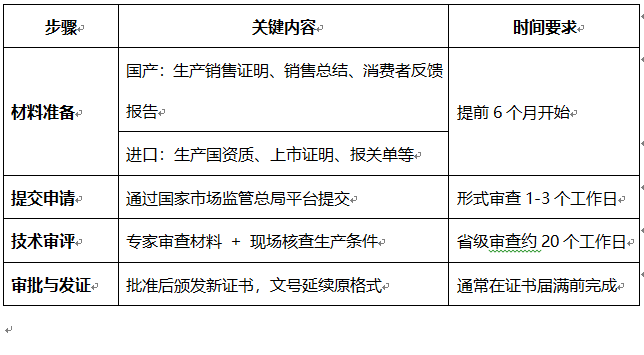
以上流程及要点均基于现行法规及实务经验整理,建议企业结合地方细则(如山西省换证方案)具体执行。
(更多细节可参考国家市场监督管理总局官网或咨询专业机构之一 如:小蓝中康)
小蓝中康(北京)科技有限公司-保健食品研发领域领先技术服务商,为您提供研发·注册·备案·转让的管家式服务。
注:以上内容均由AI搜集总结并生成,仅供参考。若您期望获取专业服务,请致电400-070-1617进行咨询。












